Trong hóa học vô cơ, phản ứng giữa AgNO3 NaCl là một thí nghiệm thường gặp, đặc biệt trong chương trình phổ thông. Đây là phản ứng đặc trưng để nhận biết ion Cl⁻ trong dung dịch muối halogenua. Vậy phương trình phản ứng diễn ra như thế nào? Hiện tượng quan sát được ra sao? Hãy cùng tìm hiểu chi tiết.
1. Phương trình hóa học AgNO3 NaCl
Khi cho dung dịch AgNO3 (bạc nitrat) tác dụng với dung dịch NaCl (natri clorua), phản ứng trao đổi kép xảy ra:
-
AgNO3: dung dịch không màu.
-
NaCl: dung dịch không màu.
-
AgCl: kết tủa màu trắng, không tan trong nước.
-
NaNO3: dung dịch muối tan.
2. Hiện tượng của phản ứng AgNO3 NaCl
Khi trộn hai dung dịch với nhau, ngay lập tức xuất hiện kết tủa trắng AgCl. Đây chính là dấu hiệu nhận biết ion Cl⁻.
AgCl có một đặc điểm thú vị là:
-
Không tan trong nước.
-
Có thể tan trong dung dịch NH3 loãng tạo thành phức chất
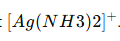
3. Ý nghĩa và ứng dụng
Phản ứng AgNO3 NaCl không chỉ quan trọng trong giảng dạy mà còn ứng dụng nhiều trong thực tiễn:
-
Nhận biết ion Cl⁻ trong phân tích định tính hóa học.
-
Ứng dụng trong chuẩn độ bạc nitrat (phương pháp Mohr) để xác định hàm lượng muối clorua trong dung dịch.
-
Minh họa thí nghiệm trực quan trong dạy học, giúp học sinh dễ hình dung về phản ứng trao đổi và sự tạo kết tủa.
4. Lưu ý khi tiến hành thí nghiệm
-
Cần dùng dung dịch loãng, vừa đủ để tránh lãng phí hóa chất.
-
Kết tủa AgCl phải được xử lý đúng cách sau thí nghiệm, không đổ trực tiếp ra môi trường.
-
Khi làm việc với AgNO3, tránh để dung dịch tiếp xúc trực tiếp với da, vì có thể gây vết đen do bạc bám.
5. Kết luận
Phản ứng AgNO3 NaCl là phản ứng trao đổi đặc trưng, tạo ra kết tủa trắng AgCl. Đây là một trong những phản ứng quan trọng, vừa có ý nghĩa lý thuyết trong nhận biết ion clorua, vừa có giá trị thực tiễn trong phân tích hóa học.