Trong hóa học vô cơ, sự chuyển hóa NO ra NO2 là một phản ứng quan trọng thường gặp trong chương trình phổ thông và cả trong các quá trình tự nhiên. Đây là phản ứng oxi hóa của khí nitơ oxit (NO) thành khí nitơ điôxít (NO2) dưới tác dụng của oxi.
1. Phương trình hóa học NO ra NO2
Khi khí NO tiếp xúc với oxi trong không khí, phản ứng xảy ra như sau:
-
NO: khí không màu, ít tan trong nước.
-
O2: khí oxi có sẵn trong không khí.
-
NO2: khí màu nâu đỏ, có mùi hắc, độc hại.
2. Hiện tượng phản ứng NO ra NO2
-
Ban đầu khí NO không màu, khó nhận biết.
-
Khi phản ứng với oxi, khí NO2 màu nâu đỏ xuất hiện, dễ dàng quan sát bằng mắt thường.
Chính vì vậy, phản ứng này thường được xem là minh chứng trực quan trong các thí nghiệm hóa học về oxi hóa – khử.
3. Ý nghĩa và ứng dụng
Phản ứng NO ra NO2 có nhiều vai trò quan trọng:
-
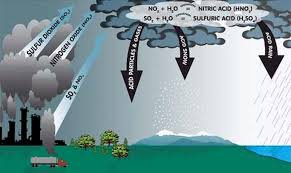
Trong tự nhiên: phản ứng này xảy ra trong khí quyển, góp phần hình thành mưa axit do NO2 kết hợp với hơi nước tạo HNO3.
-
Trong công nghiệp: quá trình sản xuất axit nitric theo phương pháp Ostwald dựa trên việc oxi hóa NO thành NO2 rồi hấp thụ vào nước.
-
Trong giáo dục: phản ứng được sử dụng làm thí nghiệm minh họa cho quá trình oxi hóa khí.

4. Lưu ý an toàn
-
NO2 là khí độc, gây hại cho đường hô hấp, vì vậy cần tiến hành phản ứng trong phòng thí nghiệm có hệ thống hút khí.
-
Không được hít trực tiếp khí NO2 và phải có biện pháp xử lý an toàn sau thí nghiệm.
5. Kết luận
Phản ứng NO ra NO2 là một trong những phản ứng oxi hóa điển hình, vừa có giá trị lý thuyết, vừa có ứng dụng trong công nghiệp sản xuất axit nitric. Tuy nhiên, do NO2 là chất độc, cần chú ý biện pháp bảo hộ và xử lý an toàn khi thực hiện.