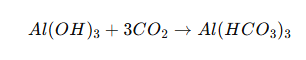Giới thiệu
Trong hóa học vô cơ, nhôm hiđroxit (Al(OH)₃) là một hợp chất rắn màu trắng, khó tan trong nước, nổi bật với tính lưỡng tính. Điều này có nghĩa là Al(OH)₃ có thể phản ứng vừa với axit, vừa với bazơ. Một trong những phản ứng tiêu biểu minh họa cho tính chất này là sự tác dụng với khí cacbonic (CO₂). Phản ứng Al(OH)₃ + CO₂ có ý nghĩa cả trong giảng dạy lẫn thực tiễn, đặc biệt trong lĩnh vực xử lý nước và môi trường.
Phương trình phản ứng Al(OH)₃ + CO₂
Khi cho khí CO₂ sục vào dung dịch có chứa kết tủa Al(OH)₃, phản ứng xảy ra theo phương trình:
-
Chất tham gia:
-
Al(OH)₃: chất rắn màu trắng, kết tủa
-
CO₂: khí không màu, tan trong nước tạo axit yếu H₂CO₃
-
-
Sản phẩm: muối nhôm hiđrocacbonat Al(HCO₃)₃, tan được trong dung dịch.
Giải thích phản ứng
-
CO₂ khi hòa tan trong nước tạo thành axit cacbonic (H₂CO₃).
-
Axit yếu này phản ứng với Al(OH)₃, làm tan kết tủa và tạo ra muối tan.
-
Phản ứng cho thấy rõ tính chất lưỡng tính của nhôm hiđroxit: không chỉ phản ứng với axit mạnh mà còn tác dụng được với axit yếu.
Ứng dụng và ý nghĩa
-
Trong phòng thí nghiệm:
-
Phản ứng Al(OH)₃ + CO₂ thường được dùng để minh họa tính lưỡng tính trong bài học hóa học.
-
-
Trong công nghiệp:
-
Ứng dụng trong xử lý nước, kiểm soát sự hòa tan và kết tủa của các muối nhôm.
-
Có vai trò trong việc nghiên cứu cơ chế tạo thành muối hiđrocacbonat trong môi trường giàu CO₂.
-
-
Trong tự nhiên:
-
CO₂ trong không khí hòa tan vào đất và nước ngầm có thể phản ứng với các hợp chất chứa nhôm, góp phần vào quá trình phong hóa khoáng chất.

-
Bài tập minh họa

Kết luận
Phản ứng Al(OH)₃ + CO₂ là một minh chứng quan trọng cho tính lưỡng tính của nhôm hiđroxit. Quá trình này không chỉ giúp củng cố kiến thức lý thuyết trong hóa học mà còn có giá trị thực tiễn trong công nghiệp và môi trường. Hiểu rõ cơ chế phản ứng giúp ứng dụng hiệu quả trong xử lý nước, sản xuất hóa chất cũng như nghiên cứu các hiện tượng tự nhiên.