Giới thiệu
Magiê (Mg) là kim loại kiềm thổ quen thuộc, có mặt nhiều trong vỏ Trái Đất dưới dạng các hợp chất như dolomit hay magie cacbonat. Khi cho magiê tiếp xúc với nước (H₂O), phản ứng xảy ra phụ thuộc vào điều kiện. Đây là một trong những phản ứng cơ bản minh họa tính khử của kim loại kiềm thổ. Việc nghiên cứu phản ứng Mg + H₂O có ý nghĩa trong học tập cũng như ứng dụng thực tiễn.
Phương trình phản ứng Mg + H₂O
Phản ứng giữa magie và nước phụ thuộc vào trạng thái nước:
-
Ở nhiệt độ thường:
-
Magie gần như không phản ứng với nước lạnh vì bề mặt kim loại được bảo vệ bởi lớp oxit MgO mỏng, bền.
-
-
Khi đun nóng nước:
![]()
-
Với hơi nước ở nhiệt độ cao:
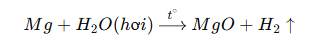
-
Chất tham gia: Mg (rắn, kim loại màu trắng bạc), H₂O (lỏng hoặc hơi).
-
Sản phẩm: MgO (rắn, chất rắn trắng) và H₂ (khí).
Giải thích phản ứng
-
Magie có tính khử, nhưng yếu hơn nhiều so với kiềm và canxi, bari.
-
Do lớp oxit bảo vệ, Mg không phản ứng với nước lạnh, chỉ khi gặp nước nóng hoặc hơi nước thì phản ứng mới xảy ra.
-
Sản phẩm H₂ sinh ra minh chứng cho khả năng khử của magie, trong khi Mg bị oxi hóa thành Mg²⁺.
Ứng dụng thực tiễn
-
Trong công nghiệp:
-
Phản ứng Mg + H₂O được nghiên cứu để sản xuất khí H₂ trong các điều kiện đặc biệt.
-
MgO sinh ra được ứng dụng trong vật liệu chịu lửa, gốm sứ và xi măng.
-
-
Trong phòng thí nghiệm:
-
Thí nghiệm dùng hơi nước và Mg để minh họa tính khử của kim loại kiềm thổ.
-
-
Trong đời sống:
-
Hiểu rõ cơ chế phản ứng giúp nâng cao an toàn khi bảo quản magie, tránh để kim loại tiếp xúc với hơi nước ở nhiệt độ cao.
-
Bài tập minh họa

Kết luận
Phản ứng Mg + H₂O là ví dụ điển hình về tính khử của kim loại magie. Ở điều kiện thường, phản ứng hầu như không xảy ra, nhưng khi gặp hơi nước nóng, Mg bị oxi hóa tạo MgO và giải phóng khí H₂. Đây là kiến thức quan trọng trong hóa học vô cơ, đồng thời có ý nghĩa trong công nghiệp và nghiên cứu ứng dụng vật liệu chịu lửa.

