1. Giới thiệu
Trong hóa học vô cơ, các phản ứng giữa muối, axit và bazơ thường được dùng để nhận biết, điều chế hoặc ứng dụng trong thực tế. Một ví dụ tiêu biểu là phản ứng ZnS + HCl, thường xuất hiện trong chương trình phổ thông cũng như thực tiễn đời sống. Bài viết này sẽ giúp bạn hiểu rõ bản chất phản ứng, phương trình, hiện tượng quan sát được và ý nghĩa ứng dụng.
2. Ký hiệu và đặc điểm của các chất
2.1. Kẽm sunfua (ZnS)
- Công thức hóa học: ZnS
- Trạng thái: chất rắn, bột màu trắng hoặc vàng nhạt, không tan trong nước.
- Tính chất: là muối sunfua ít tan, khi gặp axit mạnh sẽ giải phóng khí H2S có mùi đặc trưng (trứng thối).
- Ứng dụng: chế tạo bột huỳnh quang, vật liệu phát quang, sơn chống cháy.
2.2. Axit clohiđric (HCl)
- Công thức: HCl
- Trạng thái: dung dịch không màu, mùi hắc, tan nhiều trong nước.
- Tính chất: là một axit mạnh, tham gia phản ứng với kim loại, muối, oxit bazơ và bazơ.
3. Phản ứng ZnS + HCl
Khi cho kẽm sunfua tác dụng với dung dịch axit clohiđric, xảy ra phản ứng trao đổi tạo muối tan và khí.
Phương trình hóa học:
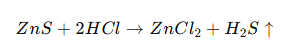
3.1. Hiện tượng
- Xuất hiện khí H2S có mùi trứng thối rất khó chịu.
- Muối kẽm clorua ZnCl2 tan trong dung dịch.
3.2. Bản chất phản ứng
- Ion S²⁻ trong ZnS kết hợp với ion H⁺ từ HCl để tạo thành khí H2S.
- Đây là phản ứng axit mạnh tác dụng với muối sunfua của kim loại.
4. Ý nghĩa và ứng dụng
- Nhận biết muối sunfua: chỉ cần nhỏ dung dịch HCl loãng vào chất rắn, nếu xuất hiện mùi trứng thối đặc trưng, chứng tỏ có mặt của ion sunfua.
- Điều chế khí H2S trong phòng thí nghiệm: phản ứng ZnS + HCl là một cách phổ biến để thu khí hiđro sunfua với lượng nhỏ phục vụ thí nghiệm phân tích.
- Ứng dụng trong phân tích hóa học: H2S sinh ra được dùng để kết tủa một số ion kim loại nặng trong dung dịch (như Pb²⁺, Cu²⁺, Hg²⁺).
- Ý nghĩa học tập: giúp học sinh nắm vững quy luật phản ứng của muối sunfua với axit mạnh.

5. Lưu ý an toàn
- Khí H2S rất độc, có mùi khó chịu, dễ gây ngộ độc nếu hít phải nhiều. Vì vậy, thí nghiệm phải tiến hành trong tủ hút khí độc hoặc nơi thoáng gió.
- Không nên hít trực tiếp để nhận biết, chỉ cần quan sát hiện tượng và dùng giấy quỳ tẩm dung dịch Pb(OAc)2 (chì(II) axetat), khí H2S sẽ tạo kết tủa đen PbS.
6. Kết luận
Phản ứng ZnS + HCl là phản ứng đặc trưng của muối sunfua với axit mạnh, tạo thành muối tan ZnCl2 và khí H2S có mùi đặc trưng. Đây là thí nghiệm quan trọng trong phân tích hóa học, giúp nhận biết ion sunfua và điều chế khí H2S trong phòng thí nghiệm.